RESULTADOS DE APRENDIZAJE PRPUESTO.
Aplica el control de calidad en la preparación de medios de cultivo
FUNDAMENTACIÓN
Actualemnte los medios de cultivo para microorganismos se preparan a partir de productos deshidratados, suplementados con aditivos de procedencia comercial, por lo que estos deben de ser fabricados bajo normas de preparación y control de calidad.
INTRODUCCIÓN.
El medio de cultivo es la combinación
sólida o
líquida de nutrientes y agua. Usualmente incluye
sales inorgánicas,
carbohidratos y
vitaminas y aminoácidos. A menudo se denomina Medio Basal y puede ser suplementado con algún
regulador de crecimiento y ocasionalmente con otras sustancias varias.
Los nutrientes son esenciales para el crecimiento y desarrollo de la planta: sin agua y nutrientes minerales una planta no puede vivir ni
in vitro ni
in vivo. También se debe añadir azúcares al medio de cultivo, ya que las plantas (o sus fragmentos) no son completamente autotróficas cuando se desarrollan en estas condiciones.
pH
Cuando se prepara un medio de cultivo, después de añadir todos sus componentes, se procede a ajustar el pH final al valor deseado, añadiendo OHNa 0.1 N o HCl 0.1N al medio. Una vez ajustado el pH se procede a esterilizar el medio.
El pH final del medio de cultivo es un factor importante por diversas razones:
- Valores bajos, inferiores a 3.5 impiden la solidificación de los agentes gelificantes añadidos a los medios sólidos
- Si la evolución del pH del medio lo hace bajar por debajo de 3.5 se puede producir su licuación.
- El valor del pH puede afectar a la solubilidad de algunos componentes del medio de cultivo
- El valor del pH puede afectar a la absorción de determinados nutrientes por parte del explanto (p.e. la absorción de iones NO3-aumenta con la acidez del medio)
- El valor del pH del medio puede afectar al pH del citoplasma y como consecuencia a la actividad de muchos enzimas
Por todas estas razones conviene optimizar el pH del medio para cada caso en concreto. En general, no obstante, en la mayoría de situaciones se trabaja a pH entre 5.2 y 5.8.
Una vez ajustado el pH del medio, este sufrirá una ligera acidificación durante el proceso de esterilización en autoclave, para, después, evolucionar nuevamente durante el decurso del cultivo, de forma que habitualmente se irá acidificando progresivamente como resultado de la absorción diferencial de algunos componentes del medio de cultivo, así como de la excreción de exudados por parte del explanto.
El control del pH inicial del medio y de su dinámica durante el cultivo tiene una gran importancia en el desarrollo de cualquier proyecto de cultivo
in vitro. A pesar de su importancia, en muchos experimentos este control se limita a fijar su valor inicial sin reparar en los posibles efectos de su dinámica.
LA TEMPERATURA
Introducción
La temperatura a la que está expuesto el explanto cultivado
in vitro afecta a la mayoría de procesos fisiológicos y por consiguiente es un factor fundamental a controlar.
En general, cada especie tiene un intervalo de temperaturas en el que se produce el crecimiento óptimo. Este intervalo puede variar en función del genotipo, del órgano del que se ha obtenido el explanto, de la época del año, de la edad de la planta madre, del fotoperíodo, etc. Una complicación adicional se produce por el hecho de que puede existir interacción entre la temperatura óptima de crecimiento y otros factores como la luz, la composición del medio (p.e: en algunos casos se ha comprobado que se obtiene mayor rendimiento haciendo fluctuar la temperatura según el fotoperíodo)
Determinar la temperatura óptima de crecimiento para cada cultivo
in vitro puede ser un proceso muy laborioso que, además, exige gran cantidad de cámaras de cultivo reguladas de forma diferente. Afortunadamente, y para la mayoría de situaciones, se pueden obtener resultados satisfactorios con temperaturas de incubación que oscilan entre los 20 y 28
0C.
El control de la temperatura no es solamente importante porque pueda afectar al crecimiento del cultivo sino también porque puede ser un factor que induzca determinados procesos fisiológicos. Así, temperaturas bajas (del orden de 4-5
0C) permiten superar los periodos de dormición de algunas leñosas y la conservación prolongada de determinados cultivos in vitro; mientras que una temperatura constante de 20
0 C induce la formación de raices en la mayoría de coníferas.
¿Como se controla?
El cultivo in vitro se realiza dentro de espacios denominados
cámaras de cultivo, diseñados para permitir el control del ambiente físico al que será expuesto el cultivo
LA LUZ
La luz, definida como una forma de energía radiante que se nos manifiesta mediante la visión es, en realidad, parte de un fenómeno físico más amplio: la energía radiante (radiación), que puede ser descrito según dos modelos diferentes: el modelo ondulatorio (radiación electromagnética) y el modelo corpuscular.
Los diferentes tipos de radiación electromagnética se pueden clasificar según sea su longitud de onda, así podemos obtener un espectro electromagnético formado por las diferentes longitudes de onda de la radiación electromagnética, que van desde los 10
-16 m hasta los 10
4m. De todas estas longitudes de onda sólo las comprendidas entre 380 y 775 nm pueden ser percibidas por el ojo humano: ese conjunto de radiaciones es el que denominamos luz en el lenguaje coloquial.
Como quiera que sólo una parte de la energía radiante (la luz y algunas de las radiaciones infrarrojas y ultravioletas próximas) tiene influencia conocida sobre el desarrollo de las plantas, a veces, se usa el término luz para referirnse a ese conjunto de radiaciones cuando en realidad se refiere al conjunto de radiaciones electromagnéticas con efectos fisiológicos.
La luz es uno de los factores principales que determinan el desarrollo de los organismos autótrofos, en ello radica la importancia de controlar el factor luz en los cultivos
in vitro.
Los aspectos relacionados con la luz que son importantes en los cultivos
in vitro son:
La cantidad de luz que incide sobre las superficies fotosintéticas de las plantas determinará en gran medida la capacidad fotosintética de éstas. Esta cantidad de luz puede ser medida de formas diversas, bien midiendo la iluminación de una superficie y expresándola en lux (en realidad se trata de una unidad definida en términos de percepción del ojo humano); o bien midiendo la irradiancia, es decir, la energía radiante que llega a una superficie dada en un intervalo de tiempo. La irradiancia puede ser expresada en función de la energía: Wm
-2 ; o en función de los fotones: µmol m
-2 s
-1
Cuando el sensor del equipo con el que medimos la irradiancia está diseñado para detectar solo las longitudes de onda comprendidas entre 400 y 700 nm, obtenemos una medida de la radiación fotosintéticamente activa (PAR)
Se asume que las necesidades de luz de los cultivos
in vitro son inferiores a las de la planta
in vivo, dado que el medio de cultivo contiene cantidades importantes de sacarosa, los cultivos
in vitro se comportan sólo parcialmente de forma autotrófica. Además, una irradiación excesiva produciría un aumento notable de la temperatura dentro del recipiente de cultivo debido al efecto invernadero.
La irradiación habitual en el campo (a plena insolación puede llegar a 450 W m
-2) es nociva en condiciones
in vitro. Es habitual usar irradiaciones mucho menores (un 10% o incluso menos del valor de plena insolación)
La luz es esencial para las plantas debido a que proporciona la energía necesaria para la fotosíntesis. La clorofila y los demás pigmentos fotosintéticos captan la energía contenida en diferentes radiaciones para incorporarla a las diversas reacciones químicas que constituyen el proceso. Pero la luz tambien puede intervenir en otros procesos fisiológicos, como el fototropismo, la germinación, la floración,...
Todos estos fenómenos no son producidos en igual medida por todos los tipos de luz (radiaciones de cualquier longitud de onda) sino que algunas radiaciones concretas tienen un efecto notable mientras que otras tiene poco o ningún efecto. Es por ello que es preciso conocer el espectro de la radiación que es activo en el proceso fisiológico estudiado. La cámara de cultivo deberá reproducir lo mejor posible ese espectro de luz activo, por lo tanto conviene conocer cual es el espectro que emiten nuestras fuentes de luz y en que medida se adapta éste a las necesidades de nuestro cultivo.
La tabla siguiente resume las principales fuentes de luz usadas en las cámaras de cultivo
| LAMPARAS INCANDESCENTES | Producen la luz por fenómenos de incandescencia del filamento calentado por el paso de la corriente eléctrica. Buena parte del espectro se halla en la zona del rojo/rojo lejano. Producen gran cantidad de calor y mucho consumo de electricidad. |
| LAMPARAS FLUORESCENTES | Producen la luz por fenómenos de fluorescencia del gas sometido a un arco voltáico. El espectro de la luz producida es rico en la zona del azul, existen fluorescentes especiales con un espectro rico en la zona azul y roja. Consumen menos electricidad. |
| LAMPARAS DE VAPOR DE MERCURIO Y SODIO | Producen la luz por efecto del paso de la corriente eléctrica a través de gases calientes de mercurio (azul y verde) y sodio (naranja). Son altamente eficientes en el consumo de electricidad. |
De todas ellas, son los fluorescentes las fuente de luz más usada en las cámaras de cultivo, aunque también se pueden encontrar, generalmente en instalaciones industriales, lamparas de vapor.
Algunos fenómenos propios del desarrollo de las plantas (germinación, floración, tuberización,...) pueden ser activados por el número de horas diarias de luz que recibe la planta. De forma análoga, el número de horas de luz que recibe el explanto cultivado
in vitro puede afectar a su desarrollo. En general, el mejor fotoperiodo
in vivo será también el mejor fotoperiodo
in vitro.






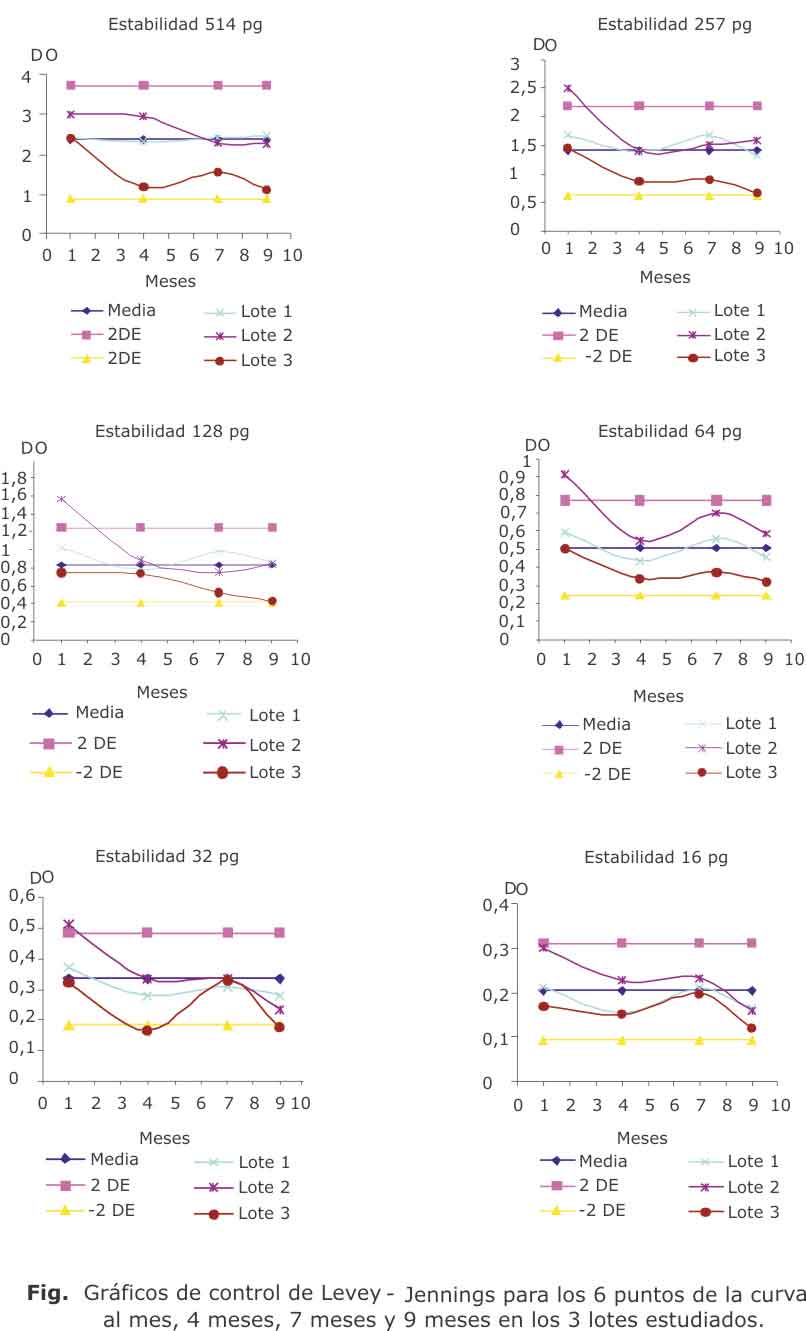

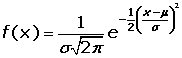
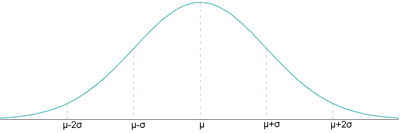
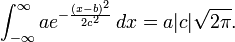
 , en cuyo caso la función gaussiana es la
, en cuyo caso la función gaussiana es la 

